Tentang KamiPedoman Media SiberKetentuan & Kebijakan PrivasiPanduan KomunitasPeringkat PenulisCara Menulis di kumparanInformasi Kerja SamaBantuanIklanKarir
2025 © PT Dynamo Media Network
Version 1.100.9
Konten dari Pengguna
Pengertian dan Contoh Osmosis dalam Larutan Kimia yang Perlu Diketahui
14 November 2021 16:42 WIB
·
waktu baca 3 menitTulisan dari Berita Hari Ini tidak mewakili pandangan dari redaksi kumparan
ADVERTISEMENT
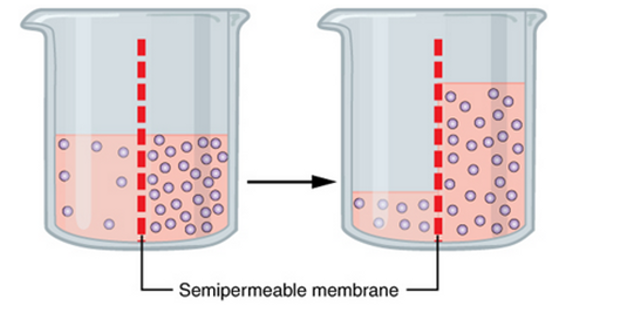
Osmosis adalah peristiwa perpindahan molekul air melalui membran semipermeabel dari yang berkonsentrasi rendah ke yang berkonsentrasi tinggi. Dalam prosesnya, molekul pelarut bermigrasi dari larutan encer ke larutan yang lebih pekat hingga mencapai kesetimbangan konsentrasi.
ADVERTISEMENT
Air berperan sebagai pelarut yang bersifat universal, sedangkan membran semipermeabel hanya dapat dilalui oleh molekul tertentu. Jadi, osmosis adalah difusi air dari daerah yang berkonsentrasi rendah (hipotonik) ke daerah berkonsentrasi tinggi (hipertonik) hingga menghasilkan larutan seimbang (isotonik).
Pada osmosis, biasanya perpindahan terjadi hanya satu arah karena yang bergerak adalah air. Tujuannya tidak lain untuk melarutkan zat terlarut (solute) sampai terjadi ekuilibrium pada kedua larutan. Seperti apa contoh osmosis? Untuk mengetahuinya, simak penjelasan berikut.
Contoh Osmosis dalam Larutan Kimia
Seperti disebutkan di awal, osmosis merupakan proses perpindahan molekul pelarut dari larutan encer ke larutan yang lebih pekat. Peristiwa ini akan berlangsung hingga mencapai suatu kesetimbangan yang ditandai dengan berhentinya perubahan volume larutan.
Mengutip buku Teknik Prosedural Keperawatan: Konsep dan Aplikasi Kebutuhan Dasar Klien karya Asmadi, kecepatan osmosis bergantung pada konsentrasi solute di dalam larutan, suhu larutan, muatan listrik solute, dan perbedaan tekanan osmosis. Sedangkan tekanannya, bergantung pada konsentrasi molekul di dalam larutan.
ADVERTISEMENT
Bila konsentrasi molekulnya tinggi, maka tekanan osmosis pada larutan tersebut tinggi. Sehingga, air akan tertarik masuk kemalam larutan tersebut.
Tekanan osmotik larutan disebut juga osmolalitas yang dapat dipengaruhi oleh jumlah albumin dan natrium. Proses ini sering terjadi antara cairan intravaskuler dengan ekstravaskuler. Misalnya, osmosis air dari interstitial ke venule bersamaan dengan perpindahan karbondioksida, urea, dan sampah metabolisme lainnya untuk diekskresi oleh tubuh.
Tekanan osmosis memainkan peranan penting dalam sistem hidup. Misalnya, dinding sel darah merah berfungsi sebagai membran semipermeabel terhadap pelarut sel darah merah.
Penempatan sel darah merah dalam larutan yang hipertonik relatif terhadap cairan dalam sel menyebabkan cairan sel keluar sehingga mengakibatkan sel mengerut. Proses pengerutan sel seperti ini disebut krenasi.
Penempatan sel darah dalam larutan yang hipotonik relatif terhadap cairan dalam sel menyebabkan cairan masuk ke dalam sel, sehingga sel darah merah akan pecah. Proses ini dinamakan hemolisis.
ADVERTISEMENT
Seseorang yang membutuhkan pengganti cairan tubuh, baik melalui infus maupun meminum cairan pengganti ion tubuh harus memperhatikan konsentrasi cairan tersebut. Ini penting dilakukan untuk mencegah krenasi dan hemolisis.
Mengutip buku Mudah dan Aktif Belajar Kimia untuk Kelas XII SMA, berikut beberapa contoh osmosis dalam kehidupan sehari-hari yang bisa Anda simak:
(MSD)

