Tentang KamiPedoman Media SiberKetentuan & Kebijakan PrivasiPanduan KomunitasPeringkat PenulisCara Menulis di kumparanInformasi Kerja SamaBantuanIklanKarir
2025 © PT Dynamo Media Network
Version 1.102.2
Konten dari Pengguna
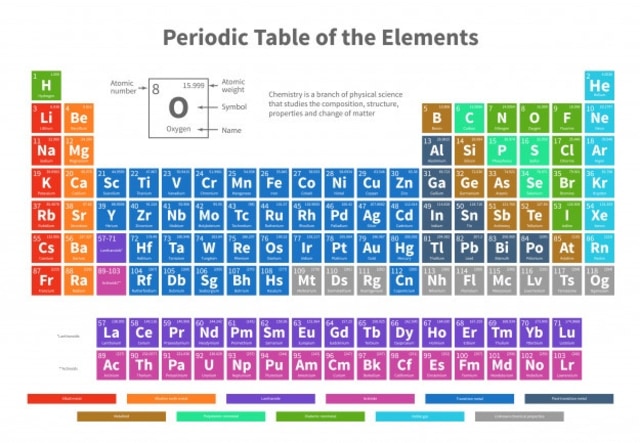
Tabel Periodik Unsur dengan Konfigurasi Elektron
14 Desember 2020 9:50 WIB
Tulisan dari Berita Update tidak mewakili pandangan dari redaksi kumparan
ADVERTISEMENT
Tabel periodik unsur berdasarkan pada hukum periodik modern yang menyatakan bahwa sifat fisik dan kimia dari unsur-unsur adalah fungsi periodik dari nomor atom mereka. Tabel periodik ini disusun oleh Moseley yang berdasarkan kepada tabel periodik Mendeleev kemudian diperbaiki dan selanjutnya menjadi dasar bagi penyusunan tabel periodik unsur modern.
ADVERTISEMENT
Susunan periodik yang disusun oleh Moseley akhirnya berkembang lebih baik sampai didapatkan bentuk yang sekarang ini dengan mengikuti hukum periodik bahwa:
Hubungan Sistem Tabel Periodik Unsur dengan Konfigurasi Elektron
Adapun posisi unsur-unsur dalam table periodik ditentukan oleh bilangan kuantum utama dari unsur elektron terakhir. Dimana, konfigurasi elektron ini dibagi menjadi 2 jenis yaitu konfigurasi elektron dalam periode dan konfigurasi elektron dalam golongan.
1. Golongan Utama
Unsur-unsur golongan utama adalah unsur-unsur yang konfigurasi elektronnya berakhir pada subkulit s atau subkulit p. Aturan penomoran golongan unsur utama adalah:
ADVERTISEMENT
2. Golongan Transisi
Unsur-unsur transisi adalah unsur-unsur yang konfigurasi elektronnya berakhir pada subkulit d. Unsur-unsur transisi baru dijumpai mulai periode 4. Pada setiap periode ditemukan 10 buah unsur transisi, sesuai dengan jumlah elektron yang dapat ditampung pada subkulit d.
Diberi nama transisi karena terletak pada daerah peralihan antara bagian kiri dan kanan sistem periodik. Aturan penomoran golongan unsur transisi adalah:
ADVERTISEMENT
3. Transisi Dalam
Unsur-unsur transisi dalam adalah unsur-unsur yang pengisian elektronnya berakhir pada subkulit f. Unsur-unsur transisi dalam hanya dijumpai pada periode keenam dan ketujuh dalam sistem periodik. Unsur-unsur ini baru dibagi menjadi dua golongan besar, yaitu unsur lantanida dan unsur aktinida.
Unsur-unsur lantanida (seperti lantanum) adalah unsur-unsur yang elektron terakhirnya mengisi subkulit 4f dan unsur-unsur aktinida (seperti aktinum), adalah unsur-unsur yang elektron terakhirnya mengisi subkulit 5f.
Jika melihat dari ciri-cirinya maka tabel periodik ini bisa melihat kesamaan sifat fisik dan kimia, kesamaan elektron luar dan kecenderungan jumlah unsur. Itulah tadi pembahasan singkat mengenai tabel periodik unsur modern yang memiliki hubungan dengan konfigurasi elektron pada suatu zat kimia.
ADVERTISEMENT
(RN)

