Tentang KamiPedoman Media SiberKetentuan & Kebijakan PrivasiPanduan KomunitasPeringkat PenulisCara Menulis di kumparanInformasi Kerja SamaBantuanIklanKarir
2025 © PT Dynamo Media Network
Version 1.102.1
Konten dari Pengguna
Hipotesis Avogadro dan Contoh Penerapannya dalam Kehidupan Sehari-hari
18 Januari 2022 18:05 WIB
·
waktu baca 3 menitTulisan dari Kabar Harian tidak mewakili pandangan dari redaksi kumparan
ADVERTISEMENT
Hipotesis Avogadro atau yang terkadang disebut sebagai hukum Avogadro. Nama dari hipotesis ini berasal dari nama penemunya, yakni Amadeo Avogadro.
ADVERTISEMENT
Hipotesis Avogadro adalah suatu hipotesis atau pendapat terkait gas eksperimen yang mengaitkan volume gas dengan jumlah zat gas tersebut.
Sebelum munculnya hipotesis Avogadro, seorang ahli kimia bernama Gay Lussac telah mengemukakan hukum yang bernama hukum perbandingan volume atau hukum Gay Lussac.
Untuk melengkapi pendapat yang telah disampaikan oleh Gay Lussac, seorang ilmuwan asal Italia yang bernama Amedeo Avogadro melakukan sebuah penelitian.
Pada penelitiannya, Avogadro kemudian menghasilkan suatu hipotesis yang sampai saat ini disebut sebagai hipotesis Avogadro.
Hipotesis Avogadro
Dikutip dari buku Kimia Paket C Tingkatan V Modul Tema 5 terbitan Kemdikbud, Avogadro melakukan eksperimen atau percobaan pada tahun 1811 menghasilkan hipotesis atau hukum Avogadro.
Avogadro mengemukakan bahwa suatu unsur tidak harus berupa atom yang berdiri sendiri, tetapi dapat juga berupa molekul yang merupakan gabungan dari atom-atom sejenis.
ADVERTISEMENT
Menurut Avogadro, molekul ini kemudian dikenal dengan molekul unsur. Avogadro menjelaskan hukum perbandingan gas dengan mengajukan hipotesis sebagai berikut:
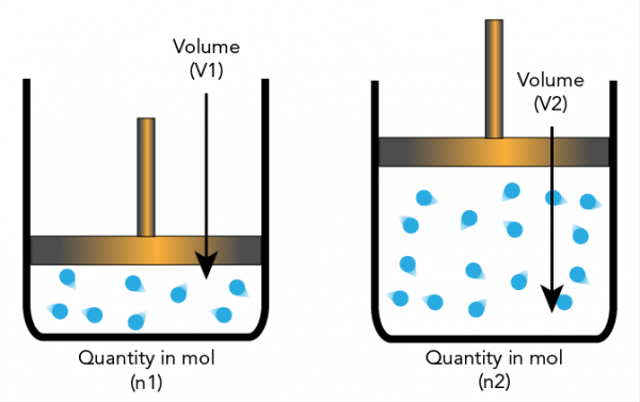
Untuk memahami hipotesis, perhatikan tabel data percobaan penentuan jumlah molekul beberapa gas pada volum 1L, suhu dan tekanan standar (0°C, 76 cmHg) di bawah ini.
Dari data yang terdapat dalam tabel tersebut dapat dilihat bahwa dalam volume yang sama dan keadaan yang sama terdapat jumlah molekul yang sama pula.
Berdasarkan penjelasan di atas, dapat disimpulkan, hipotesis Avogadro menyatakan bahwa pada suhu dan tekanan yang sama, semua gas dengan volume yang sama akan mengandung jumlah molekul yang sama pula.
Penerapan Hipotesis Avogadro
Hipotesis Avogadro dapat diamati dalam beberapa peristiwa dalam kehidupan sehari-hari. Berikut contoh penerapan hipotesis Avogadro.
ADVERTISEMENT
1. Pernapasan
Pada proses pernapasan, paru-paru akan bergerak secara mengembang kemudian mengempis atau yang dikenal sebagai kondisi yang diakibatkan oleh aktivitas otot difragma.
Saat otot diafragma berkontraksi rongga dada membesar dan paru-paru mengembang. Akibatnya, udara masuk ke dalam paru-paru. Saat otot diafragma relaksasi, diafragma kembali ke keadaan semula.
Ketika kondisi otot diafragma kembali normal, rongga dada menyempit, mendorong paru-paru sehingga mengempis.
Hal ini juga disebabkan oleh perubahan volume di dalam paru-paru yang setara dengan jumlah molekul udaranya. Oleh karena itu, proses pernapasan merupakan penerapan dari hipotesis Avogadro.
2. Ban
Sama halnya dengan proses pernapasan, pada aktivitas memompa ban juga merupakan penerapan dari hipotesis Avogadro
Ketika ban bocor dipompa, gas akan masuk ke dalam ban yang kemudian mengakibatkan ban membesar karena mengalami proses pengembangan.
ADVERTISEMENT
Saat gas di dalam ban bocor, maka ban akan mengempis kemudian kembali ke bentuk semula. Hal ini disebabkan oleh adanya peningkatan jumlah molekul udara di dalam ban sepeda yang setara dengan volumenya yang juga meningkat.
(SAI)

