Tentang KamiPedoman Media SiberKetentuan & Kebijakan PrivasiPanduan KomunitasPeringkat PenulisCara Menulis di kumparanInformasi Kerja SamaBantuanIklanKarir
2025 © PT Dynamo Media Network
Version 1.94.0
Konten dari Pengguna
Hukum Kekekalan Massa: Pengertian, Rumus, hingga Contohnya
18 Januari 2022 12:43 WIB
·
waktu baca 3 menitTulisan dari Kabar Harian tidak mewakili pandangan dari redaksi kumparan
ADVERTISEMENT
Hukum kekekalan massa adalah nama lain dari hukum Lavoisier. Hukum kekekalan massa sendiri merupakan salah satu hukum dasar dalam ilmu kimia .
ADVERTISEMENT
Hukum kekekalan menjelaskan terkait massa dari suatu zat dalam suatu proses reaksi terjadi. Secara luas, hukum kekekalan massa biasanya digunakan dalam bidang-bidang, seperti kimia, teknik kimia, mekanika, dan dinamika fluida.
Untuk memahami lebih lanjut mengenai hukum kekekalan massa, simak penjelasan di bawah ini.
Pengertian Hukum Kekekalan Massa
Dikutip dari buku Kimia Paket C Tingkatan V Modul Tema 5 yang diterbitkan oleh Kementerian Pendidikan dan Kebudayaan RI, hukum kekekalan massa adalah hukum yang menjelaskan bahwa massa zat sebelum bereaksi sama dengan massa zat setelah bereaksi.
Hukum kekekalan massa atau dikenal juga sebagai hukum Lomonosov-Lavoisier adalah suatu hukum yang menyatakan massa dari suatu sistem tertutup akan konstan meskipun terjadi berbagai macam proses di dalam sistem tersebut.
ADVERTISEMENT
Bunyi dari hukum kekekalan massa adalah:
Pernyataan yang biasanya digunakan untuk menyatakan hukum kekekalan massa adalah massa dapat berubah bentuk tetapi tidak dapat diciptakan atau dimusnahkan.
Jika dilihat dari ilmu relativitas spesial, kekekalan massa adalah pernyataan dari kekekalan energi. Massa partikel yang tetap dalam suatu sistem ekuivalen dengan energi momentum pusatnya.
Dalam beberapa peristiwa terjadinya radiasi, ditemukan proses perubahan suatu massa menjadi energi. Hal ini bisa terjadi apabila suatu benda berubah menjadi benda yang memiliki energi kinetik ataupun energi potensial.
Karena massa dan energi saling berhubungan, pada suatu sistem yang menerima atau melepaskan energi, massa dalam jumlah yang sangat sedikit akan terbentuk atau hilang dari sistem.
Akan tetapi, dalam hampir seluruh peristiwa yang melibatkan perubahan energi, hukum kekekalan massa dapat digunakan karena massa yang berubah sangatlah sedikit.
ADVERTISEMENT
Rumus Hukum Kekekalan Massa
Mengutip dari buku Optimal Transport: Old and New karya Cédric Villani, rumus dari hukum kekekalan massa adalah sebagai berikut:
Sejarah Hukum Kekekalan Massa
Hukum kekekalan massa adalah hukum yang dikemukakan oleh seorang ahli bernama Antoine Lavoisier pada tahun 1789. Tak heran, hukum ini sering disebut sebagai hukum Lavoisier.
Penemuannya terkait hukum kekekalan massa ini menyebabkan Lavoisier dijuluki sebagai seorang bapak kimia modern.
Dalam percobaannya, Antoine Laurent Lavoisiser melakukan percobaan dengan memanaskan merkuri oksida (HgO). Reaksi yang ditimbulkan dari logam merkuri dan gas oksigen dengan reaksi atau adalah:
2HgO(l)+O2(g)→2Hg(s)+2O2(g)
Sebelumya, pada tahun 1748, ide ini pernah dikemukakan Mikhail Lomonosov yang telah membuktikannya dalam eksperimen tersebut.
Contoh Hukum Kekekalan Massa
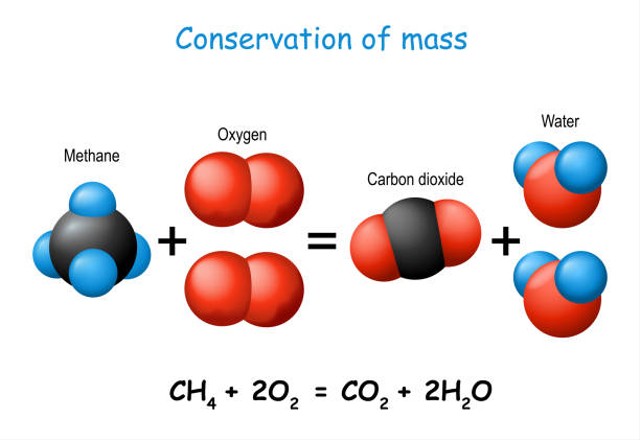
Seperti yang telah disebutkan sebelumnya, hukum kekekalan massa adalah hukum yang terjadi pada proses reaksi kimia, yang mana massa reaktan harus sama dengan atau setara dengan massa produk.
ADVERTISEMENT
Hukum kekekalan dapat diamati pada berbagai macam reaksi kimia, salah satunya adalah pada proses pembentukan hidrogen dan oksigen dari air.
Apabila hidrogen dan oksigen dibentuk dari 36 g air, maka bila reaksi berlangsung hingga seluruh air habis, akan diperoleh massa campuran produk hidrogen dan oksigen sebesar 36 g.
Bila reaksi masih menyisakan air, massa campuran hidrogen, oksigen dan air yang tidak bereaksi tetap sebesar 36 g.
Air -> Hidrogen + Oksigen (+ Air)
(36 g) (36 g)
(SAI)

