Tentang KamiPedoman Media SiberKetentuan & Kebijakan PrivasiPanduan KomunitasPeringkat PenulisCara Menulis di kumparanInformasi Kerja SamaBantuanIklanKarir
2025 © PT Dynamo Media Network
Version 1.100.3
Konten dari Pengguna
5 Perkembangan Model dalam Teori Atom pada Pelajaran Kimia
28 November 2022 17:04 WIB
·
waktu baca 2 menitTulisan dari Berita Terkini tidak mewakili pandangan dari redaksi kumparan
ADVERTISEMENT
Pernahkah membayangkan suatu materi dibagi terus sampai tidak bisa dibagi lagi? Demokritus (460-370SM) dalam bahasa Yunani menyebutnya sebagai atomos. Konsep tersebut dimodelkan oleh banyak ahli, lalu muncul beberapa teori atom yang terkenal. Berikut kami sebutkan 5 perkembangan model atom yang diambil dari buku Kimia 1 untuk Kelas X SMA/MA (2009) yang ditulis oleh Poppy K. Devi dan kawan-kawan.
ADVERTISEMENT
1. Model Atom Dalton
John Dalton pada tahun 1808 mengungkapkan:
Kelebihan:
Mampu menjelaskan Hukum Kekekalan Massa dan Hukum Perbandingan Tetap.
Kelemahan:
Tidak dapat menjelaskan mengapa 2 atom hidrogen harus bergabung dengan satu atom oksigen pada pembentukan air.
2. Model Atom Thomson
Sir J.J. Thompson pada tahun 1897 menyatakan:
Kelebihan:
ADVERTISEMENT
Menggunakan model menyerupai roti kismis.
Kelemahan:
Bertentangan dengan percobaan Geiger dan Marsden.
Baca juga: Teori Atom Modern dan Perkembangannya
3. Model Atom Rutherford
Ernest Rutherford pada tahun 1911 mengungkapkan bahwa:
Kelebihan:
Sesuai dengan percobaan Geiger dan Masden.
Kelemahan:
Belum dapat menjelaskan mengapa elektron tidak jatuh ke inti atom.
4. Model Atom Bohr
Niels Bohr pada tahun 1913 menyatakan bahwa:
ADVERTISEMENT
Kelebihan:
Sesuai dengan eksperimen Balmer, Lyman, Paschen dan Brackett.
Kelemahan:
Bertentangan dengan azas ketidakpastian Heisenberg.
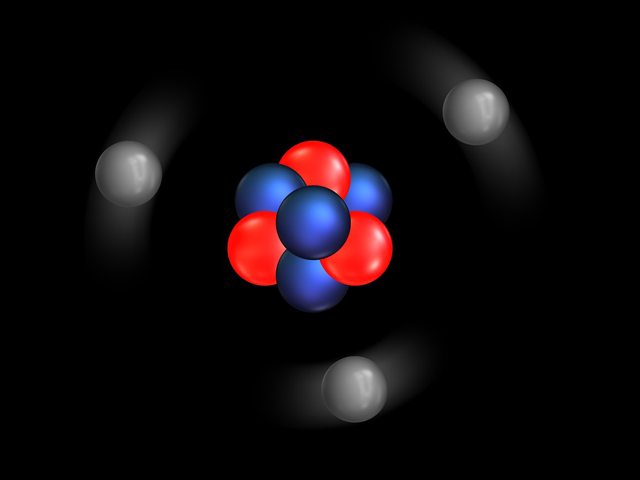
5. Model Atom Modern
Ini merupakan hasil kerjasama Rutherford dan Bohr pada tahun 1927, yaitu:
Model atom mekanika kuantum ini digunakan hingga sekarang.
Perkembangan ilmu kimia merupakan hasil perenungan, lalu menjadi konsep, kemudian dikembangkan dalam bentuk teori dan diuji menggunakan model, contohnya model atom. Butuh waktu berabad-abad untuk melakukan percobaan dan akan terus berlanjut. (LUS)
Bursa Efek Indonesia (BEI) membekukan sementara perdagangan (trading halt) sistem perdagangan pada pukul 11:19:31 waktu Jakarta Automated Trading System (JATS). Hal ini dipicu oleh penurunan Indeks Harga Saham Gabungan (IHSG) mencapai 5,02% ke 6.146.

